REAKSI REDOKS
(Kelompok 2)
1. Mardiana (A1F008012)
2. Suryadi (A1F008053)
3. Erisa F Nadeak (A1F008028)
4. Irfan Taswin (A1F008037)
5. Fitriati Irhami (A1F008004)
6. Mira Ningsih E. P (A1F008044)
7. Ade Gustanti (A1F008022)
8. Jemi Andala (A1F008009)
PERTEMUAN PERTAMA
A. Kompetensi
• Standar Kompetensi : Memahami sifat-sifat larutan non elektrolit dan non elektrolit serta reaksi oksidasi reduksi
• Kompetensi Dasar : Menjelaskan perkembangan konsep reaksi reduksi oksidasi serta penerapannya
• Indikator :
* Membedakan konsep oksidasi, reduksi ditinjau dari penggabungan dan pelepasan oksigen, pelepasan dan penerimaan elektron serta peningkatan dan penurunan bilangan oksidasi
* Menentukan bilangan oksidasi atom unsur dalam senyawa atau ion
* Menentukan oksidator dan reduktor dalam reaksi redoks
* Mendeskripsikan konsep redoks dalam memecahkan masalah linkungan
B. Pengantar
Dalam kehidupan sehari-hari kita sering menemui beberapa hal menarik seperti terjadinya perubahan warna pada daging buah apel setelah dibelah, peristiwa pembakaran kayu, peristiwa perkaratan besi, bau busuk akibat penumpukkan sampah, pemanfaatan kompor untuk memasak.
 |
| Pembakaran Kayu |
 |
| Perubahan Warna Pada Daging Buah Apel Setelah Dibelah |
 |
| Perkaratan Besi |
 |
| Bau Busuk Akibat Sampah |
 |
| Peristiwa Pembakaran Pada Kompor |
Perubahan warna pembakaran kayu perkaratan besi pada daging buah apel setelah dibelah. Bau busuk peristiwa pembakaran akibat sampah pada kompor.
Pada buah apel ketika baru dibelah, daging buah apel berwarna putih. Namun, setelah dibiarkan beberapa saat menjadi cokelat. Mengapa hal itu terjadi? Reaksi apa yang menyebabkan perubahan warna daging buah apel tersebut? Begitu juga pada peristiwa pembakaran kayu, perkaratan besi, peristiwa timbulnya bau busuk pada penumpukan sampah, dan pengunaan kompor untuk memasak. Jenis reaksi apakah yang terjadi? Mengapa besi tersebut bisa berkarat? Semua fenomena tersebut akan dibahas dalam materi ini yaitu berkaitan dengan reaksi redoks.
C. Sejarah Perkembangan Teori Redoks
Sebelum melangkah lebih jauh tentang reaksi redoks sebaiknya kita mengetahui terlebih dahulu bagaimana sejarah perkembangan hingga timbulnya teori redoks.
Dari beberapa abad sebelum Masehi, orang telah mengenal api, terutama pada peristiwa pembakaran. Sejak saat itu para ahli pengetahuan mulai tertarik tentang proses pembakaran. Kemudian pada abad ke-16, melalui eksperiment Boyle mengemukakan bahwa pada pembakaan terjadi penggabungan antara benda yang dibakar dengan partikel api.
Abad ke-17, George Stahl mengemukakan bahwa apabila benda dibakar, maka benda itu akan kehilangan sesuatu yang disebut plongiston, sehingga apabila benda terbakar massanya bertambah. Teori ini berlaku untuk logam-logam, tetapi untuk batu bara tidak. Batu bara apabila dibakar, massa arang yang terbentuk berkurang. Oleh karena itulah pada tahun 1772, Lavoiser meneliti peristiwa pembakaran bermacam-macam logam dengan udara. Lavoisier mengatakan bahwa bertambahnya berat logam bila dibakar dalam udara disebabkan karena adanya reaksi antara logam tersebut dengan gas yang ada di udara, oksigen. Selanjutnya ahli-ahli kimia mulai mengklasifikasikan reaksi suatu zat dengan oksigen dan diberi istilah reaksi oksidasi.
D. Konsep Dasar Reaksi Redoks
Reaksi kimia dapat digolongkan ke dalam reaksi redoks dan reaksi bukan redoks. Reaksi redoks adalah reaksi yang berkaitan dengan peristiwa reduksi dan oksidasi. Reaksi redoks banyak terjadi dalam kehidupan sehari-hari, misalnya perkaratan besi, reaksi-reaksi pembakaran, oksidasi makanan dalam sel, fotosintesis, dan peleburan bijih logam, aki, baterai, dan berbagai proses elektrolisis seperti penyepuhan. Dalam mempelajari reaksi redoks ada beberapa konsep dasar yang harus dipahami, seperti :
1. Oksidasi :
• Penambahan/pengikatan atom oksigen
• Pelepasan Elektron
• Naiknya bilangan oksidasi
2. Reduksi
• Pengurangan atom oksigen
• Penambahan Elektron
• Turunnya bilangan oksidasi
3. Reduktor (Pereduksi)
• Zat yang mengalami oksidasi
4. Oksidator (pengoksidasi)
• Zat yang mengalami reduksi
5. Reaksi Redoks
• Reaksi yang mengandung peristiwa reduksi dan oksidasi
6. Reaksi autoredoks (disproporsionasi)
• Reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama
7. Bilangan oksidasi
• Muatan suatu atom jika elektron ikatan diberikan kepada atom yang keelektronegatifannya lebih besar.
E. Perkembangan konsep Redoks
Pengertian reaksi reduksi dan oksidasi telah mengalami berbagai perkembangan. Pada awalnya peristiwa reduksi oksidasi dikaitkan dengan pelepasan dan pengikatan oksigen. Pada perkembangan selanjutnya oksidasi dan reduksi dikaitkan dengan penangkapan dan pelepasan elektron, dan kemudian dengan perubahan bilangan oksidasi. Hal ini dimaksudkan untuk memberikan cakupan yang lebih luas bagi jenis reaksi tersebut.
1. Reaksi Redoks Sebagai Pengikatan dan Pelepasan Oksigen.
OKSIDASI
Oksidasi adalah reaksi pengikatan oksigen, sedangkan reduksi adalah reaksi pelepasan oksigen
1. Oksidasi suatu unsur akan menghasilkan suatu oksida.
4Fe (s) + 3O2(g) → 2Fe2O3 (s)
2Mn + O2 → 2MnO
2. Oksidasi senyawa sulfida menghasilkan oksida logam penyusunnya.
4FeS2 +11O2 → 2Fe2O3 + 8SO2
3. Oksidasi atau pembakaran senyawa karbon menghasilkan gas karbondioksida dan air.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)
C3H8 + 5O2 → 3CO2 + 4H2O
C12H22O11 + 12O2 → 12CO2 + 11H2O
REDUKSI
1. Pemanasan raksa oksida (HgO)
2HgO → 2Hg + O2
2. Pemanasan kalium klorat (KClO3)
2KClO3 → 2KCl + 3O2
Sumber oksigen pada reaksi oksidasi disebut oksidator, sedangkan zat yang menarik oksigen pada reaksi reduksi disebut reduktor.
2. REDOKS BERDASARKAN PELEPASAN DAN PENERIMAAN ELEKTRON
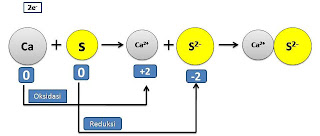
Reaksi antara unsur logam dan non logam terjadi dengan serah terima elektron. Perhatikan contoh berikut:
1. Reaksi kalsium dengan oksigen
2. Reaksi kalsium dengan belerang
Menurut konsep oksidasi reduksi terdahulu, reaksi (1) merupakan reaksi oksidasi karena merupakan pengikatan oksigen, tetapi reaksi(2) tidak termasuk oksidasi. Pada hal, dalam kedua reaksi itu kalsium mengalami hal yang sama yaitu: melepas 2 elektron. Sehingga pengertian redoks terlalu sempit jika hanya ditinjau dari pengikatan dan pelepasan oksigen. Oleh karena itu muncullah konsep reduksi oksidasi berdasarkan serah terima elektron. Oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi pengikatan/penyerapan elektron.
Pada reaksi (2) di atas kalsium mengalami oksidasi karena melepas elektron, sedangkan belerang mengalami reduksi karena menangkap elektron. Reaksi yang melibatkan oksidasi reduksi selanjutnya kita sebut reaksi redoks (reduksi-oksidasi) Sedangkan reaksi yang hanya reduksi atau oksidasi saja disebut setengah reaksi.
Contoh :
1. 2Cu + O2 → 2CuO
2Cu → 2Cu2+ + 4e (Oksidasi)
O2 + 4e → 2O2- (Reduksi)
2Cu + O2 → 2CuO (Redoks)
2. Cu + Cl2 CuCl2
Cu → Cu2+ + 2e (Oksidasi)
Cl2 + 2e → 2Cl- (Reduksi)
Cu + Cl2 → CuCl2 (Redoks)
Oksidator adalah zat yang menangkap elektron dan mengalami reduksi, sedangkan reduktor adalah zat yang melepas elektron dan mengalami oksidasi. Pada contoh diatas, kalsium dioksidasi oleh belerang. Oleh karena itu belerang merupakan pengoksidasi atau oksidator. Belerang direduksi oleh kalsium, sehingga kalsium merupakan pereduksi atau reduktor.
3. REDOKS BERDASARKAN PERUBAHAN BILANGAN OKSIDASI
Dalam berbagai reaksi redoks yang melibatkan spesi yang kompleks, kadang-kadang tidak mudah menentukan atom mana yang melepaskan elektron dan atom mana yang menangkap elektron. Perhatikan reaksi berikut :
KMnO4 + H2SO4 + H2C2O4 K2SO4 + MnSO4 + CO2 + H2O
Dari reaksi di atas, apakah anda bisa segera menentukan atom mana yang melepas elektron (mengalami oksidasi) dan yang mana yang menangkap elektron (mengalami reduksi) pada reaksi di atas?
Kerumitan tersebut dapat diatasi dengan munculnya perkembangan pengertian oksidasi reduksi dengam perubahan bilangan oksidasi. Pelepasan elektron dapat menyebabkan kenaikkan biloks, sedangkan penangkapan elektron dapat menurunkan bilangan oksidasi.
Oksidasi = pertambahan bilangan oksidasi
Reduksi = penurunan bilangan oksidasi
Contoh 1:
Contoh 2:
Reduktor = mengalami pertambahan bilangan oksidasi
Oksidator = mengalami penurunan bilangan oksidasi
PERTEMUAN KEDUA
A. Kompetensi
• Standar Kompetensi : Memahami sifat-sifat larutan non elektrolit dan non elektrolit serta reaksi oksidasi reduksi
• Kompetensi Dasar : Menjelaskan perkembangan konsep reaksi reduksi oksidasi serta penerapannya
• Indikator :
* Menentukan bilangan oksidasi atom unsur dalam senyawa atau ion
F. Konsep Bilangan Oksidasi
1. Pengertian bilangan oksidasi
Bilangan oksidasi suatu unsur dalam suatu senyawa adalah muatan yang diemban oleh atom unsur jika semua elektron ikatan didistribusikan kepada unsur yang lebih elektronegatif
Contoh :
a. Berapakah bilangan oksidasi H dan O dalam H2O ?
Rumus Lewis H2O:
O lebih elektronegatif daripada H maka elektron ikatan didistribusikan pada atom O. Jadi, biloks O = -2, sedangkan H masing-masing = +1b. Berapakah bilangan oksidasi H dan O dalam H2O2?
Bilangan oksidasi H = +1 dan O = -1 karena berdasarkan rumus Lewis H2O2 elektron ikatan pada OH didistribusikan pada atom O. Sedangkan elektron ikatan antara atom O dan atom O adalah netral karena tertarik atom sejenis. Jadi masing masing atom H kehilangan 1 elektron dan masing-masing atom O mendapat 1 elektron.
3. Berapakah bilangan oksidasi O dan F dalam OF2?
Rumus Lewis OF2 adalah :
Bilangan oksidasi F = -1 dan O = +2 4. Berapakah bilangan oksidasi Cl dalam Cl2?
Rumus Lewis Cl2 adalah :
G. ATURAN PENENTUAN BILANGAN OKSIDASI
1. Pengertian Bilangan oksidasi
Bilangan oksidasi adalah muatan suatu atom jika elektron ikatan diberikan kepada atom yang keelektronegatifannya lebih besar.
Aturan :
1. Bilangan oksidasi unsur bebas adalah nol.
2. Bilangan oksidasi monoatom sama dengan muatan ionnya.
3. Jumlah bilangan oksidasi atom-atom pembentuk ion poliatom sama dengan muatan ion poliatom tersebut.
4. 4.Jumlah bilangan oksidasi untuk semua atom dalam senyawa adalah nol.
5. Bilangan oksidasi unsur-unsur logam golongan utama (IA,IIA,IIIA) sesuai dengan nomor golongannya.
6. Bilangan oksidasi unsur-unsur logam golangan transisi lebih dari satu.
7. Biloks.hidrogen dalam senyawanya adalah +1, kecuali dalam hidrida, atom hidrogen mempunyai biloks. -1.
8. Biloks.oksigen dalam senyawanya adalah -2, kecuali dalam peroksida (-1) dan dalam senyawa biner dengan fluor (+2)
Contoh :
1. Bilangan oksidasi atom-atom pada Ne, H2, O2, Cl2, P4, S8, C, Cu, Fe,dan Na adalah nol.
2. Bilangan oksidasi Na+ = +1, bilangan oksidasi Mg2+= +2, bilangan oksidasi S2-= -2
3. Jumlah bilangan oksidasi atom S dan atom O dalam SO42- adalah -2
4. Jumlah bilangan oksidasi atom Cu dan atom O dalam CuO adalah nol.
5. Biloks.K dalam KCl,KNO3,dan K2SO4 = +1, biloks.Ca dalam CaSO4 dan biloks.Mg dalam MgSO4= +2.
6. Biloks.Cu =+1 dan +2
Fe=+2 dan +3
Sn=+2 dan +4
Pb=+2 dan +4
Au=+1 dan +3
7. Biloks. H dalam H2O,NH3 dan HCl = +1, biloks H dalam NaH dan CaH2 = -1.
8. Biloks O dalam H2O = -2
Biloks.O dalam H2O2 dan BaO2= -1
Biolks.O dalam OF2 = +2
Contoh Soal
Tentukan bilangan oksidasi dari unsur – unsur berikut :
1. S dalam senyawa HSO4-
2. Mn dalam senyawa KMnO4
3. Cr dalam senyawa Cr2O72-
Pembahasan
1. S dalam senyawa HSO4-
BO H + BO S + 4 . BO O = -1
1 + BO S + 4 . ( -2 ) = -1
BO S – 7 = -1
BO S = +6
2. Mn dalam senyawa KMnO4
BO K + BO Mn + 4 . BO O = 0
1 + BO Mn + 4 . ( -2 ) = 0
BO Mn – 7 = 0
BO Mn = +7
3. Cr dalam senyawa Cr2O72-
2 . BO Cr + 7 . BO O = -2
2 . BO Cr + 7 . ( -2 ) = -2
2 . BO Cr – 14 = -2
2 . BO Cr = +12
Cr = +6
PERTEMUAN KETIGA
A. Kompetensi
• Standar Kompetensi : Memahami sifat-sifat larutan non elektrolit dan non elektrolit serta reaksi oksidasi reduksi
• Kompetensi Dasar : Menjelaskan perkembangan konsep reaksi reduksi oksidasi serta penerapannya
• Indikator :
* Menentukan oksidator dan reduktor dalam reaksi redoks
* Mendeskripsikan konsep redoks dalam memecahkan masalah linkungan
Bagaimana cara membedakan reaksi redoks dan bukan redoks?
Suatu reaksi disebut redoks, jika pada reaksi itu terdapat zat yang mengalami reduksi dan zat yang mengalami oksidasi.
Tentukan zat reduktor, zat oksidator, hasil reduksi dan hasil oksidasi dari reaksi redoks berikut :
Zat reduktor (pereduksi) = SnCl2
Zat oksidator (pengoksidasi) = I2
Hasil reduksi = HI
Hasil oksidasi = SnCl4
Reaksi Autoredoks (Disproporsionasi)
Reaksi autoredoks adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama. Reaksi autoredos merupakan reaksi redoks dengan satu jenis atom yang bilangan oksidasinya berubah mengalami oksidasi dan reduksi sekaligus.
APLIKASI
Reaksi redoks secara alamiah selalu berlangsung di sekitar kita dalam hidup sehari-hari.
PENGARATAN LOGAM
Reaksi : 4Fe(s) + 3O2 (g) 2Fe2O3 (s)
REAKSI PEMBAKARAN
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
REDUKSI LOGAM DARI BIJIH LOGAM
1. Reduksi biji besi Fe2O3 dengan karbon monoksida (CO)
Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)
2. Reaksi kromium (III) oksida oleh aluminium
Cr2O3(s) + 2Al(s) Al2O3(s) + 2Cr(s)
3. Reduksi tembaga (II) oksida oleh gas hidrogen
CuO(s) + H2(g) Cu(s) + H2O(s)
video tentang Redoks
sumber : youtube
RANGKUMAN
EVALUASI
1. Jika kita mengamplas pita magnesium hingga bersih. Kemudian, dengan menggunakan tang besi, kita bakar pita magnesium tersebut. Lalu kita tampung abu hasil pembakaran dalam tabung reaksi. Menurut anda, zat apakah yang terbentuk pada pembakaran magnesium? Berikan komentar Anda!
2. Berdasarkan soal no.1 di atas, apakah reaksi pembakaran magnesium termasuk oksidasi atau reduksi ? Jelaskan jawabanmu!
3. Jika serbuk tembaga (II) oksidasi dan serbuk karbon, masing-masing kira-kira 5 gram dalam tabung reaksi. Kemudian campuran tersebut dipanaskan hingga terbentuk logam tembaga. Nyatakan apakah reaksi serbuk tembaga (II) dengan serbuk karbon tergolong reduksi atau oksidasi ? Jelaskan pendapatmu dan berikan komentar!
4. Menurut Anda, apakah fungsi karbon pada reaksi antara serbuk tembaga (II) oksidasi dengan serbuk karbon?
5. Pada awal reaksi redoks dikaitkan dengan oksigen. Kemudian dengan serah terima elektron dan perubahan bilangan oksidasi. Menurut anda, apakah alasan mengaitkan reaksi redoks dengan serah terima elektron dan perubahan bilangan bilangan oksidasi ? Berikan komentarmu!
DAFTAR PUSTAKA
Purba, Michael. 2002. Kimia untuk SMA Kelas X. Jakarta: Erlangga
Raharjo, Sentot B. 2008. Kimia Berbasis Eksperimen 1. Jakarta: Platinum